糖基修饰的Aza-BODIPY光敏剂研究:原位自组装为J-聚集纳米纤维、细胞膜破坏与I型光动力治疗
光动力疗法(PDT)是一种利用光敏剂(PS)在光照下敏化氧分子生成活性氧(ROS)杀灭癌细胞的方法,因其具有优良的时空可控性,已在临床上用于一些肿瘤的治疗。将PS设计为纳米结构,利用增强渗透和滞留(EPR)效应使其在肿瘤部位积累,是目前PDT研究采用的策略之一。然而,这些纳米PS的治疗效果往往受到实体瘤的乏氧状态和间质流体压力的限制。此外,这些纳米结构极易被单核吞噬细胞系统(MPS)摄入,导致PS在肝脏和脾脏中非特异性积聚,产生长期毒性。
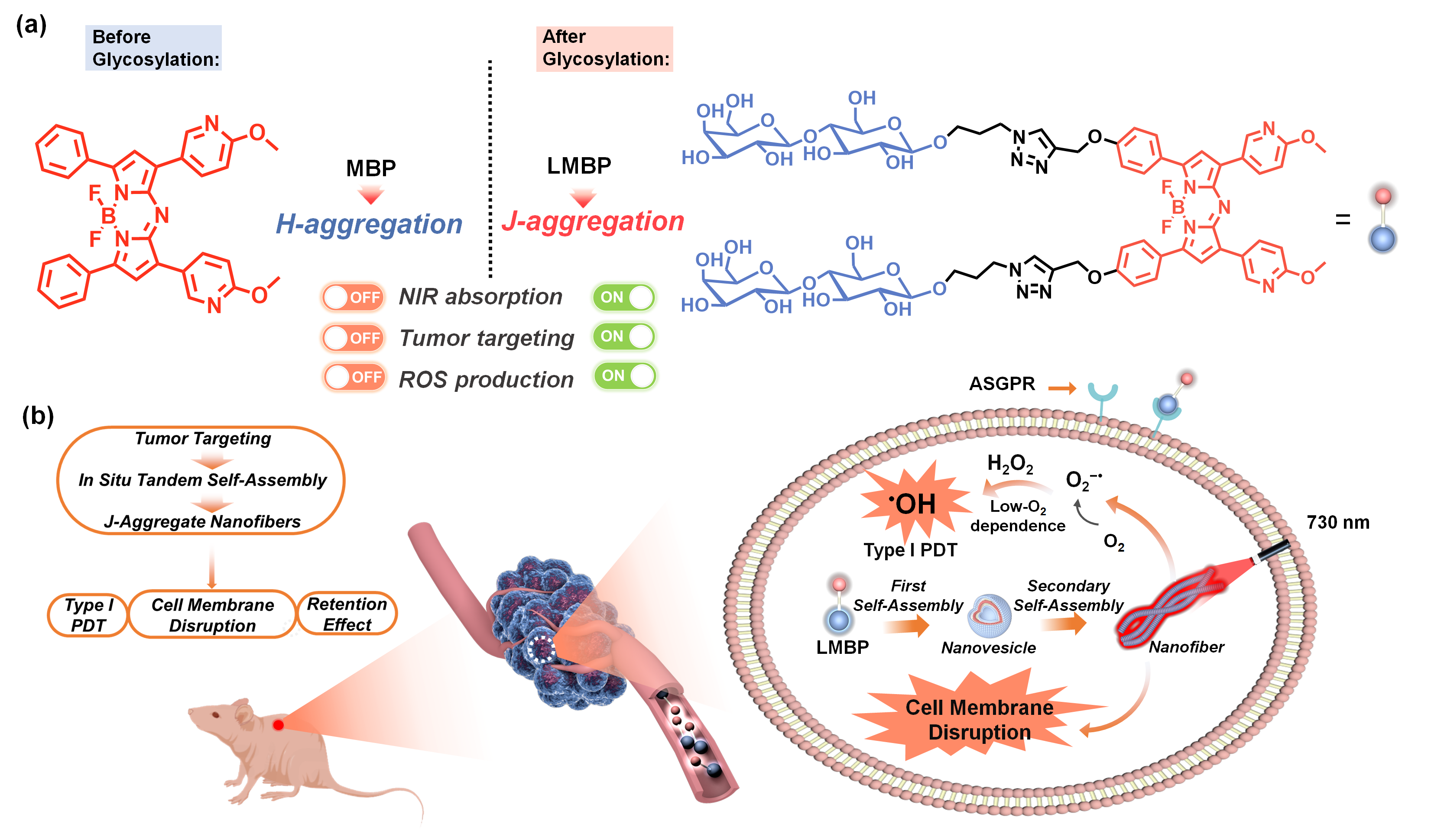
为解决上述纳米PS研究中存在的问题,永利欢乐娱人城邢国文教授课题组研发了一种原位自组装纳米系统用于高效肿瘤靶向性PDT。具体而言,使用乳糖与近红外染料Aza-BODIPY偶联制备了两亲性糖基化分子LMBP,LMBP借助乳糖基团与肝癌细胞表面去唾液酸糖蛋白受体的特异性结合进入HepG2细胞。而后随着时间的延长,LMBP在细胞内进一步原位自组装形成J聚集纳米纤维(LMBPJ)。在这个过程中,乳糖基团之间的糖-糖相互作用调节了糖基化Aza-BODIPY的自组装性质,使Aza-BODIPY排列成高度有序的J聚集体。LMBPJ能够通过高效的光诱导电子转移产生超氧阴离子自由基(O2–•),O2–•在细胞中发生Haber–Weiss/Fenton反应产生高细胞毒性的羟基自由基(•OH)实现抗乏氧I型PDT。此外,细胞内形成的纳米纤维具有显著的细胞外排受阻与长期滞留效应,导致细胞膜破裂,与PDT形成协同抗肿瘤效应。体内实验研究表明,该自组装纳米系统在小鼠模型中表现出肿瘤长期滞留效应以及优良的PDT效果,且没有明显的毒副作用。该工作为构建兼具肿瘤靶向和抗乏氧性质的超分子糖基化光敏剂提供了新思路。
该工作得到了国家自然科学基金(21977014)的资助,同时感谢永利欢乐娱人城杨清正教授和牛丽亚副教授在活性氧测试方面的帮助以及谭宏伟副教授在理论计算方面的支持。相关研究结果被《Angew. Chem. Int. Ed.》杂志接收发表,博士研究生刘怡晨为文章第一作者,邢国文教授为通讯作者(In Situ Self-Assembled J-Aggregate Nanofibers of Glycosylated Aza-BODIPY for Synergetic Cell Membrane Disruption and Type I Photodynamic Therapy. Angew. Chem. Int. Ed. 2023, e202309786)。