随着纳米技术的发展,基于活性氧(ROS)的纳米催化肿瘤治疗因其副作用较小,引起了越来越多的关注,纳米酶催化治疗也随之成为科学研究的热点。然而复杂的肿瘤微环境(TME)限制了纳米酶的催化治疗效果。近年来,为克服TME的影响,人们构建了多种基于TME响应的多功能纳米酶。但所报道的绝大多数多功能纳米酶很难同时克服TME中厌氧和高内源性谷胱甘肽(GSH)的消极影响,并且简单的叠加策略较难实现不同酶活性之间的协同作用。
鉴于此,近日永利欢乐娱人城那娜教授课题组构建了一种适配体功能化的Pd@MoO3-x纳米绣球花纳米酶(A-Pd@MoO3-x NH),用于高效肿瘤特异性治疗。利用纳米Pd的不规则形状特性,A-Pd@MoO3-x NH纳米酶同时暴露出具有过氧化氢酶活性的Pd (111)晶面和氧化酶活性的Pd (100)晶面,构成了双活性中心。这可以催化级联酶反应,在克服肿瘤厌氧的同时,进一步富集具有细胞毒性的超氧自由基(O2•−)。基于氧化还原反应,纳米酶能够有效降解消耗O2•−的GSH,避免GSH的负面影响。更重要的是,钼氧化物(MoO3-x)作为可逆电子中转站,通过氧桥和少量的Mo-Pd键,可以接收Pd (111)晶面上的电子,随后转移至Pd (100)晶面上。因此,可以协同提升双活性中心的模拟酶活性以及GSH降解能力,促进O2•−的富集。基于光谱、质谱等多种表征技术,并结合理论计算,有效证明了该双活性位点的巧妙设计,并有效实现了纳米酶的高效级联催化治疗。实验证实,在TME的弱酸性环境中,A-Pd@MoO3-x NH能够选择且高效地杀死肿瘤细胞,并得到良好的治疗效果。
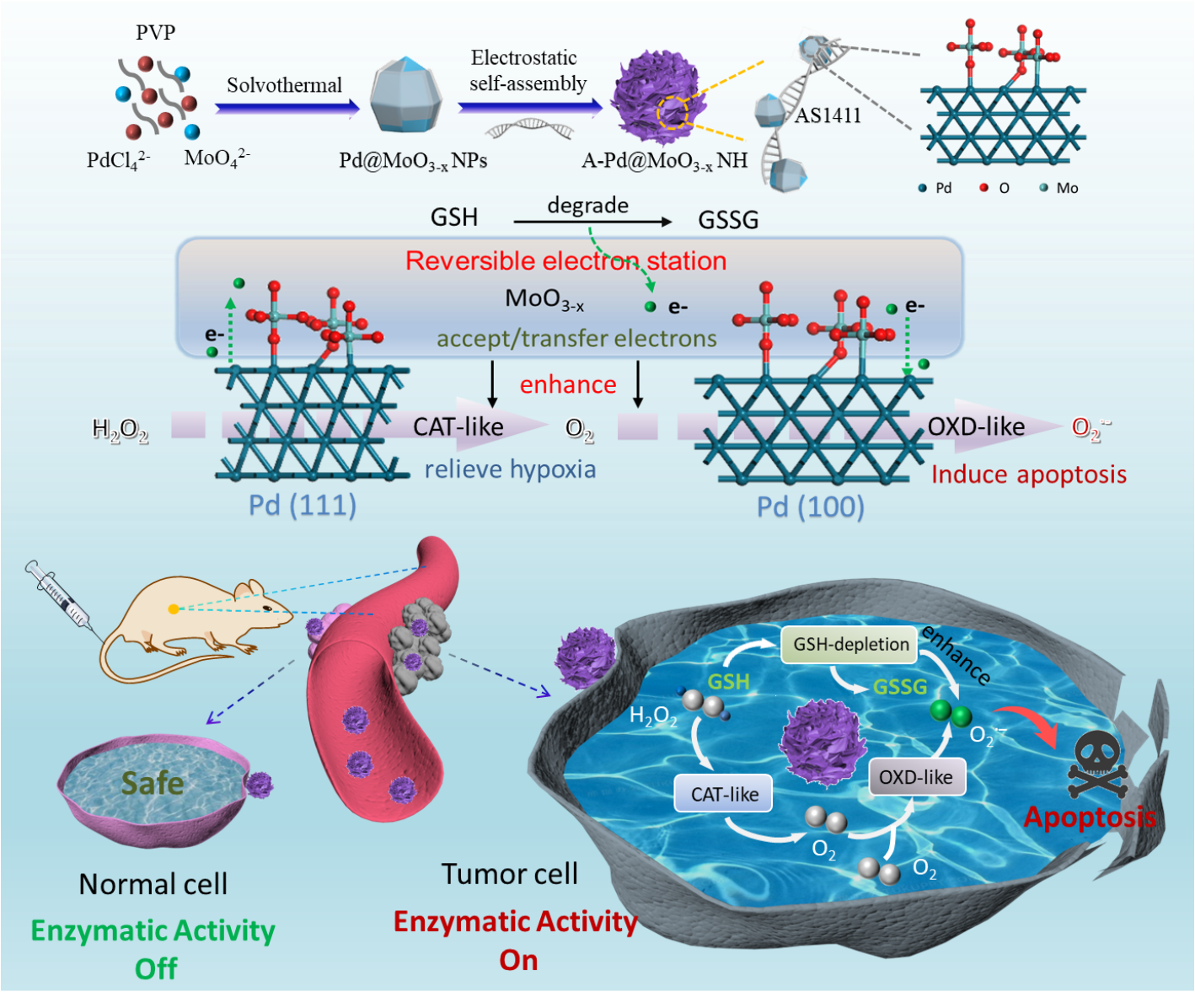
图1. A-Pd@MoO3-x NH的构建及其协同增强级联催化肿瘤特异性治疗。图片来源:J. Am. Chem. Soc.
该工作得到了国家自然科学基金(22274012, 21974010)的资助。相关研究结果近期被Journal of the American Chemical Society杂志接收发表,永利欢乐娱人城是该工作第一单位,2022级在读博士生赵齐为文章第一作者,那娜教授为通讯作者(Dual Active Centers Linked by a Reversible Electron Station as a Multifunctional Nanozyme to Induce Synergetically Enhanced Cascade Catalysis for Tumor-Specific Therapy, J. Am. Chem. Soc., 2023, 145, 12586–12600, DOI: 10.1021/jacs.3c01532)。