肿瘤乏氧是制约光动力治疗(PDT)疗效的重要因素。研究表明,通过电子/质子转移同时氧化生物分子和生成活性氧自由基的I-型敏化剂具有乏氧耐受性,在低氧浓度下仍能保持治疗效果。设计制备I-型敏化剂已成为光动力治疗研究的重要和热点方向。
利用超分子组装方法,将传统的II-型敏化剂与富电子或缺电子的组装基元共组装,拉近敏化剂与电子给/受体之间的距离促进电子转移,为成功实现I-型敏化剂的制备提供了有效方法。然而,这类敏化剂组分复杂,包括染料分子、电子给/受体和表面活性剂等,这将限制这些超分子敏化剂的应用。
最近,永利欢乐娱人城杨清正课题组提出了利用光诱导歧化反应制备单一组分的超分子I-型敏化剂。该策略利用光激发敏化剂分子到达激发态,随后和附近基态的敏化剂分子发生快速的光诱导电子转移,产生敏化剂阳离子自由基(PS+•)和阴离子自由基(PS−•),PS+•可直接氧化生物底物分子,而PS−•可将电子转移给分子氧生成超氧阴离子自由基(O2−•)。为实现这一过程,敏化剂分子需满足以下几个条件: i)敏化剂必须具有适当的激发态能级和氧化还原电位进行光诱导电子转移;ii)敏化剂的分子间距离和取向应有助于高效的电子转移;iii)在电子转移后,能够进行有效的电荷分离。
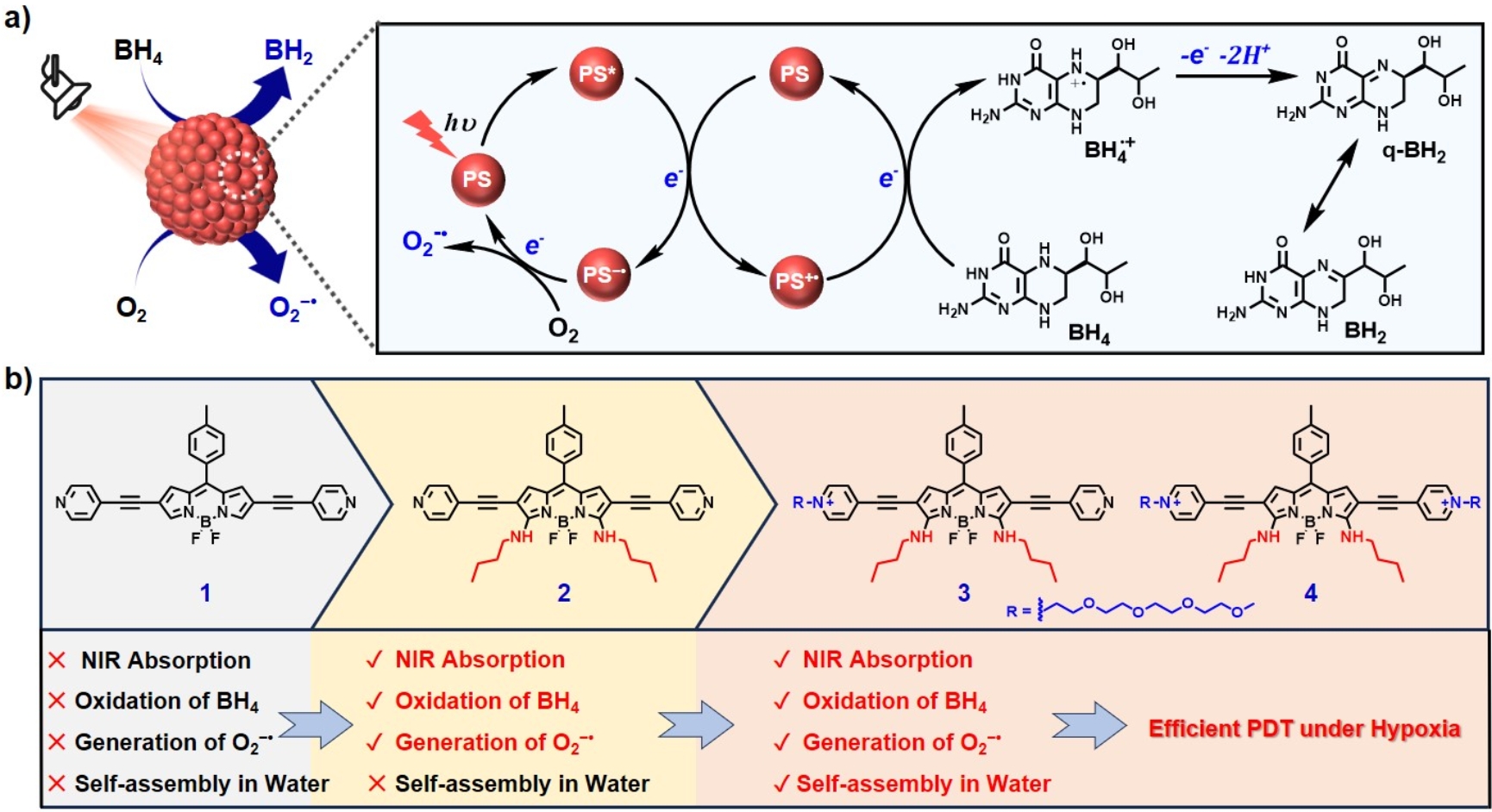
基于这一理念,该工作设计并合成了一系列基于BODIPY的敏化剂分子,通过分子结构修饰,调控敏化剂的光物理性质、氧化还原电位和水溶性。最终成功制备了一类能够在水中自组装的单一组分的I-型敏化剂,这类敏化剂可以在近红外光的照射下,发生光诱导歧化反应生成敏化剂自由基离子对(PS+•和PS−•),进而在氧化细胞内的重要辅酶四氢生物蝶呤(BH4)的同时生成O2−•。该工作系统研究了所制备敏化剂的光物理性能及光动力作用机制。通过细胞和活体实验进一步验证了该超分子敏化剂的光动力治疗性能。结果表明,这类敏化剂能够有效杀灭肿瘤细胞,并在荷瘤鼠模型中展现出优异的抗肿瘤效果。
杨清正/牛丽亚团队近年来在光动力治疗敏化剂研究领域开展了系统研究工作(J. Am. Chem. Soc. 2023, 145, 4081-4087; Adv. Mater. 2023, 35, 2209789; Nat. Commun. 2022, 13, 6179; Chem. Sci. 2022, 13, 5951-5956; Angew. Chem. Int. Ed. 2021, 60, 19912-19920),该工作是在这一研究方向的最新研究进展。该工作提出的I-型光动力治疗敏化剂的设计策略,为光动力敏化药物的设计提供了新思路。
该研究成果近日发表在Angew. Chem. Int. Ed. 2024, e202318783,文章第一作者是滕坤旭博士,通讯作者是牛丽亚副教授和杨清正教授,永利欢乐娱人城为第一完成单位。感谢国家自然科学基金委、博士后基金和永利欢乐娱人城对该研究工作的经费支持。